A Anvisa (Agência Nacional de Vigilância Sanitária) planeja flexibilizar a regra de importação, pelo Ministério da Saúde, de medicamentos sem registro, ou seja, aqueles cujos dados de qualidade e eficácia não passaram pelo crivo da agência.
Materias sobre: ANVISA
RDC 166/17 da Anvisa, sobre validação de métodos analíticos, comentada
| viewsA validação de métodos analíticos, descrita pela RDC 166/17, da Agência Nacional de Vigilância Sanitária (Anvisa), apresenta uma série de atualizações e esclarecimentos quando comparada com a norma anterior (RE 899/03). Além de ser um requerimento das Boas Práticas de Fabricação, é uma das diversas atividades importantes que asseguram a qualidade de um produto farmacêutico.
14 mil pacientes podem ficar sem medicamento após decisão da Justiça
| viewsAgência Nacional de Vigilância Sanitária (Anvisa) solicitou à Justiça a suspensão de uma liminar que autorizava o cultivo de cannabis sativa por meio da Associação Brasileira de Apoio Cannabis Esperança (Abrace). A entidade, localizada em João Pessoa, Paraíba, possui um laboratório e utiliza a erva para a produção de medicamentos à base de óleos derivados da planta, que atendem a mais de 14 mil famílias com pacientes que tratam de epilepsia, mal de Parkinson, autismo, entre outras doenças.
19 medicamentos aprovados pela Anvisa para doenças raras
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) contabilizou um recorde no número de medicamentos aprovados para tratar doenças raras em 2019: foram 19 durante todo o ano, entre sintéticos, biológicos e específicos. Além disso, o órgão sanitário ainda liberou a realização de 30 ensaios clínicos.
5 exigências da Anvisa na produção de Cosméticos no Brasil
| viewsO mercado de cosméticos e dermocosméticos é muito regulado no País. Existe legislação própria e a Agência Nacional de Vigilância Sanitária (Anvisa) tem normas abrangentes sobre várias substâncias dessa categoria. Confira neste artigo cinco linhas de produtos que têm regras específicas que devem ser observadas pelos farmacêuticos.
8 fundamentos da nova RDC 44 que você precisa conhecer
| viewsA RDC 44/09 vai mudar! Justo ela que foi considerada um dos marcos mais importantes do segmento farmacêutico brasileiro. No entanto, depois de 11 anos de vigência, essa normativa precisa ser atualizada para incorporar novos conceitos. Assim, a Agência Nacional de Vigilância Sanitária (Anvisa) lançou a Consulta Pública (CP) 911, que trata de proposta de Resolução da Diretoria Colegiada (RDC) para alterar os dispositivos relacionados a serviços de saúde contidos na RDC 44/09. A CP receberá sugestões até o dia 7 de dezembro.
A Anvisa no ICH - As principais conquistas
| viewsNo segundo semestre de 2019, a Agência Nacional de Vigilância Sanitária (Anvisa) deu um importante passo ao se tornar a única entidade de saúde da América Latina a conquistar uma vaga como membro do Comitê Gestor do Conselho Internacional para Harmonização de Requisitos Técnicos para Registro de Medicamentos de Uso Humano (ICH). Contudo, o que muita gente não sabe é que uma farmacêutica teve um papel fundamental nessa conquista: a diretora da Anvisa, Alessandra Bastos Soares.
A comissão da indústria farmacêutica para médicos na mira do Governo Federal
| viewsO Ministério da Saúde prepara a criação de uma espécie de portal da transparência para que empresas farmacêuticas divulguem pagamentos e benefícios superiores a R$ 20 mil para médicos e associações. O objetivo é dar maior publicidade na relação entre profissionais da área e fabricantes, expondo aos pacientes eventuais conflitos de interesse na prescrição de produtos.
A RDC 44/09 da Anvisa será atualizada
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) está promovendo, junto à às Vigilâncias Sanitárias (Visas) estaduais e municipais uma consulta dirigida, como o objetivo de levantar dados sobre a prestação de serviços de assistência à saúde em farmácias do País.
Alerta Anvisa determina o recolhimento de medicamentos de 4 Indústrias
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) determinou os recolhimentos (voluntários em alguns casos) de mais de nove lotes de medicamentos de quatro farmacêuticas. Entre os fármacos e empresas citadas estão os seguintes produtos: Natu Extra, da Flatnative Produtos Naturais; SlimChá, da ML Comércio de Suplementos Alimentares; Ulcerocin e Cloridrato de Ranitidina, da Cimed Indústria; e a Solução Fisiológica de Cloreto de Sódio Equiplex, da Equiplex Indústria Farmacêutica.
Alerta Anvisa: laboratórios devem informar sobre medicamentos usados na pandemia
| viewsSegundo a Agência Nacional de Vigilância Sanitária (Anvisa), a ação visa garantir o abastecimento de anestésicos, sedativos, bloqueadores neuromusculares e agentes adjuvantes usados no enfrentamento à Covid-19. É o que estabelece o Edital de Chamamento 8/20, publicado em edição extra do Diário Oficial da União de quinta-feira (13/8).
Alerta Anvisa: novo marco regulatório de IFAs está em vigor
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) informa que desde segunda-feira (3/8) está vigente o novo marco regulatório de insumos farmacêuticos ativos (IFAs). De acordo com o órgão, três Resoluções da Diretoria Colegiada (RDC) atualizam a regulação sobre o tema.
Alerta Anvisa: novos códigos de assunto para recolhimento de medicamentos
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) atualizou os códigos de assunto para peticionamentos eletrônicos relacionados ao recolhimento de medicamentos no Sistema Solicita. Os relatórios postados ou enviados por e-mail somente serão aceitos até sexta-feira (28/8).
Alerta Anvisa: rótulos devem conter aviso sobre novas fórmulas
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) definiu norma exigindo que as empresas coloquem aviso sobre novas fórmulas em produtos sujeitos à vigilância sanitária. Objetivo, segundo a Agência, é alertar sobre a presença de potenciais alergênicos. A nova regra está na Resolução da Diretoria Colegiada (RDC) 421/20, publicada ontem (3/9) no Diário Oficial da União.
Alerta Anvisa: suspeita de fraude em insumos para indústria farmacêutica
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) emitiu alerta de fraude desde que foi comunicada pelo Poder Judiciário do Paraná sobre irregularidades em uma empresa fornecedora de produtos químicos supostamente utilizados para a produção de vacinas.
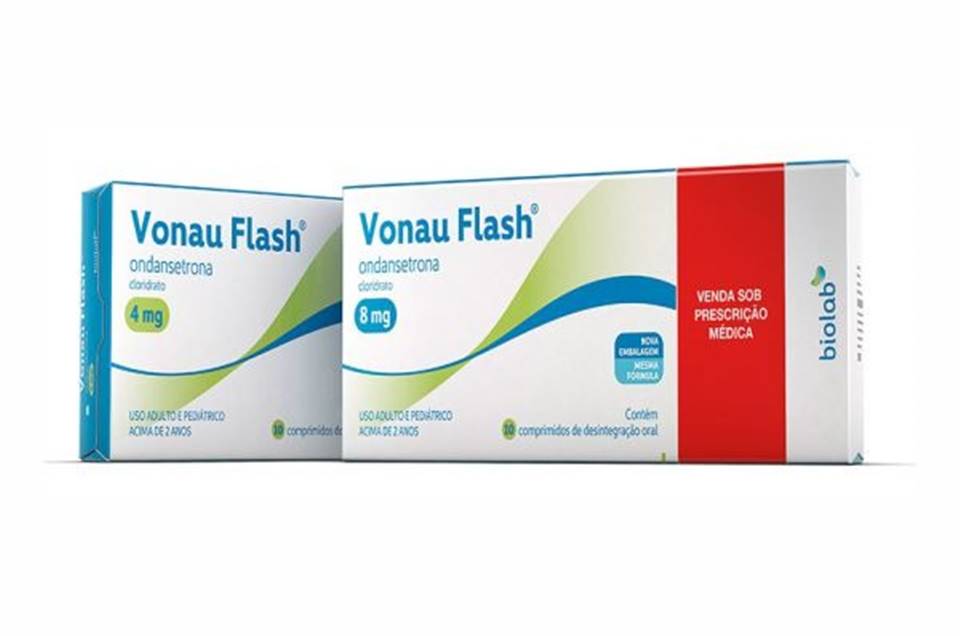
Alerta da Anvisa: medicamento causa malformação orofacial no primeiro trimestre de gravidez
| viewsA Gerência de Farmacovigilância da Agência Nacional de Vigilância Sanitária (Anvisa) determina medidas sanitárias para as empresas que comercializam medicamentos com o princípio ativo ondansetrona, em virtude do risco de ocorrência de malformações congênitas com o uso desse princípio ativo.
Alerta da Anvisa: recolhimento de 54 lotes de medicamentos de 4 laboratórios
| viewsAs empresas farmacêuticas Farma Indústria Farmacêutica, Farmace Indústria Químico-Farmacêutico Cearense, Hyporfarma - Instituto de Hypodermia e Farmácia e a Nova Química Farmacêutica anunciaram o recolhimento voluntário de mais de 54 lotes do medicamento Ranitidina, indicado para úlceras de estômago ou de duodeno.
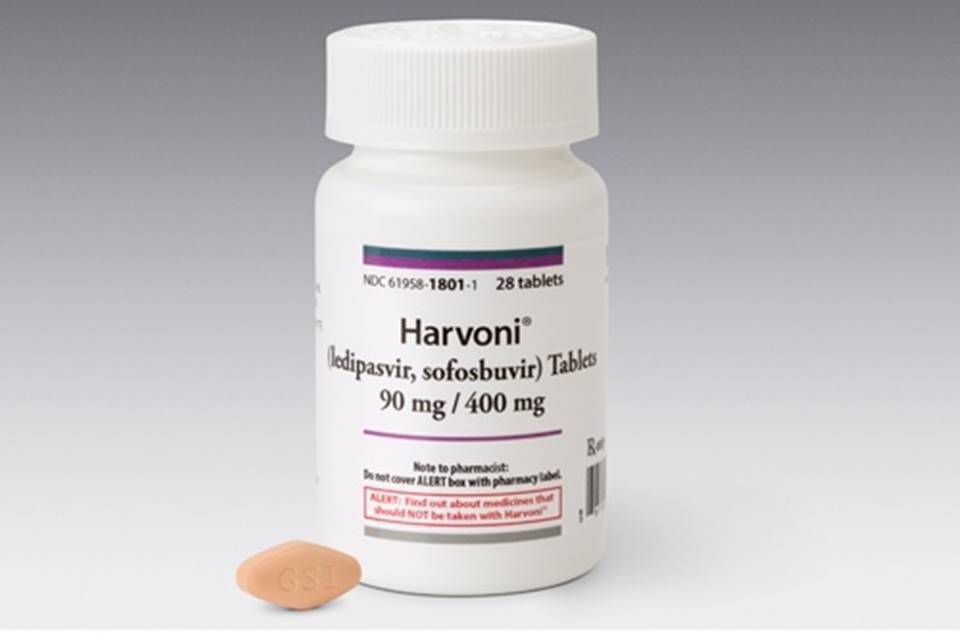
Alerta de falsificação de medicamento para hepatite C
| viewsA Anvisa alerta profissionais de saúde e pacientes para que fiquem atentos à circulação de uma versão falsificada do medicamento Harvoni, da empresa Gilead Sciences Farmacêutica do Brasil Ltda., indicado para o tratamento da hepatite C crônica (HCC), genótipo 1, em adultos e crianças acima de 12 anos.
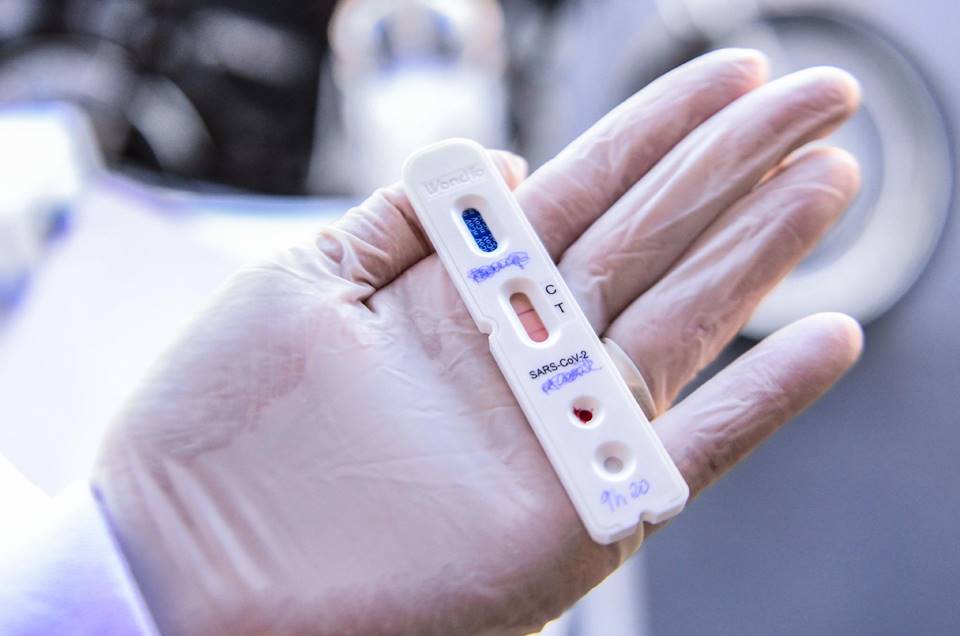
Alerta para a qualidade dos testes rápidos do coronavírus
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) já aprovou 59 testes para diagnóstico da Covid-19 no Brasil. Com tantas opções para testagem da população, é importante ficar atento à qualidade desses testes, afinal nem todos podem ser, de fato, um investimento válido. As aprovações da Agência são com base na RDC 348/20, que define os critérios e os procedimentos extraordinários de petições de registro. Entre os testes aprovados estão algumas marcas como o Livzon, HiLab, One Step Test, Allserum Eia, Biosynex etc.
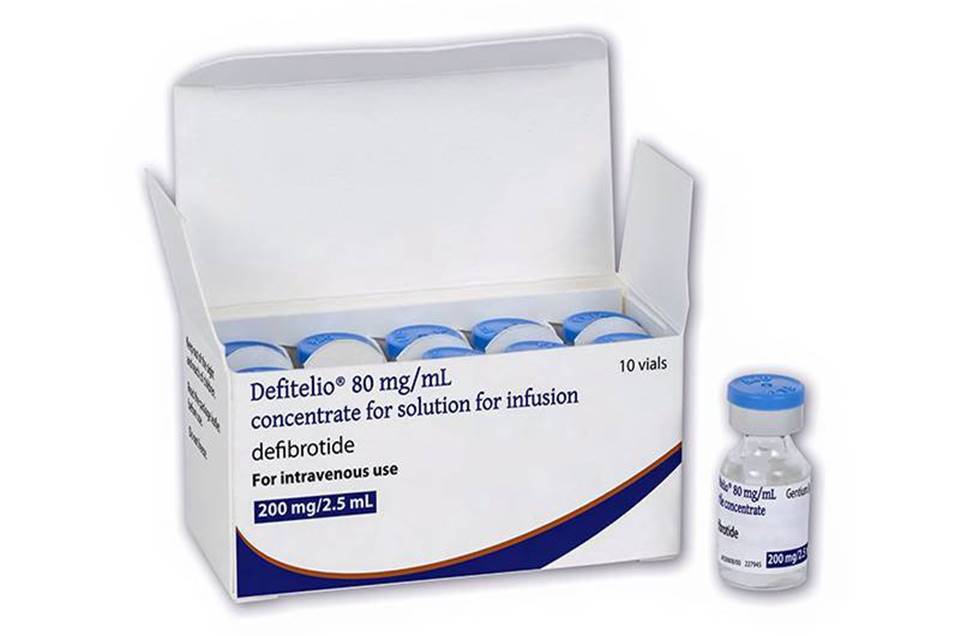
Alerta sobre falsificação do medicamento Defitelio
| viewsA Anvisa alerta os profissionais de saúde e a população para o fato de que foram identificados dois casos de falsificação do medicamento Defitelio (defibrotida), registrado no Brasil pela empresa Zodiac Produtos Farmacêuticos S/A.