A Anvisa (Agência Nacional de Vigilância Sanitária) planeja flexibilizar a regra de importação, pelo Ministério da Saúde, de medicamentos sem registro, ou seja, aqueles cujos dados de qualidade e eficácia não passaram pelo crivo da agência.
Materias sobre: Assuntos Regulatórios
19 medicamentos aprovados pela Anvisa para doenças raras
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) contabilizou um recorde no número de medicamentos aprovados para tratar doenças raras em 2019: foram 19 durante todo o ano, entre sintéticos, biológicos e específicos. Além disso, o órgão sanitário ainda liberou a realização de 30 ensaios clínicos.
4 passos fundamentais para o registro de medicamentos genéricos
| viewsCom a recente decisão do Supremo Tribunal Federal (STF) em limitar o prazo de patentes de produtos e processos farmacêuticos para no máximo 20 anos, abriu-se uma oportunidade para que as indústrias farmacêuticas possam solicitar o registro de novos medicamentos genéricos no Brasil.
5 exigências da Anvisa na produção de Cosméticos no Brasil
| viewsO mercado de cosméticos e dermocosméticos é muito regulado no País. Existe legislação própria e a Agência Nacional de Vigilância Sanitária (Anvisa) tem normas abrangentes sobre várias substâncias dessa categoria. Confira neste artigo cinco linhas de produtos que têm regras específicas que devem ser observadas pelos farmacêuticos.
A Anvisa no ICH - As principais conquistas
| viewsNo segundo semestre de 2019, a Agência Nacional de Vigilância Sanitária (Anvisa) deu um importante passo ao se tornar a única entidade de saúde da América Latina a conquistar uma vaga como membro do Comitê Gestor do Conselho Internacional para Harmonização de Requisitos Técnicos para Registro de Medicamentos de Uso Humano (ICH). Contudo, o que muita gente não sabe é que uma farmacêutica teve um papel fundamental nessa conquista: a diretora da Anvisa, Alessandra Bastos Soares.
Alerta Anvisa: laboratórios devem informar sobre medicamentos usados na pandemia
| viewsSegundo a Agência Nacional de Vigilância Sanitária (Anvisa), a ação visa garantir o abastecimento de anestésicos, sedativos, bloqueadores neuromusculares e agentes adjuvantes usados no enfrentamento à Covid-19. É o que estabelece o Edital de Chamamento 8/20, publicado em edição extra do Diário Oficial da União de quinta-feira (13/8).
Alerta Anvisa: rótulos devem conter aviso sobre novas fórmulas
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) definiu norma exigindo que as empresas coloquem aviso sobre novas fórmulas em produtos sujeitos à vigilância sanitária. Objetivo, segundo a Agência, é alertar sobre a presença de potenciais alergênicos. A nova regra está na Resolução da Diretoria Colegiada (RDC) 421/20, publicada ontem (3/9) no Diário Oficial da União.
Alerta Anvisa: suspeita de fraude em insumos para indústria farmacêutica
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) emitiu alerta de fraude desde que foi comunicada pelo Poder Judiciário do Paraná sobre irregularidades em uma empresa fornecedora de produtos químicos supostamente utilizados para a produção de vacinas.
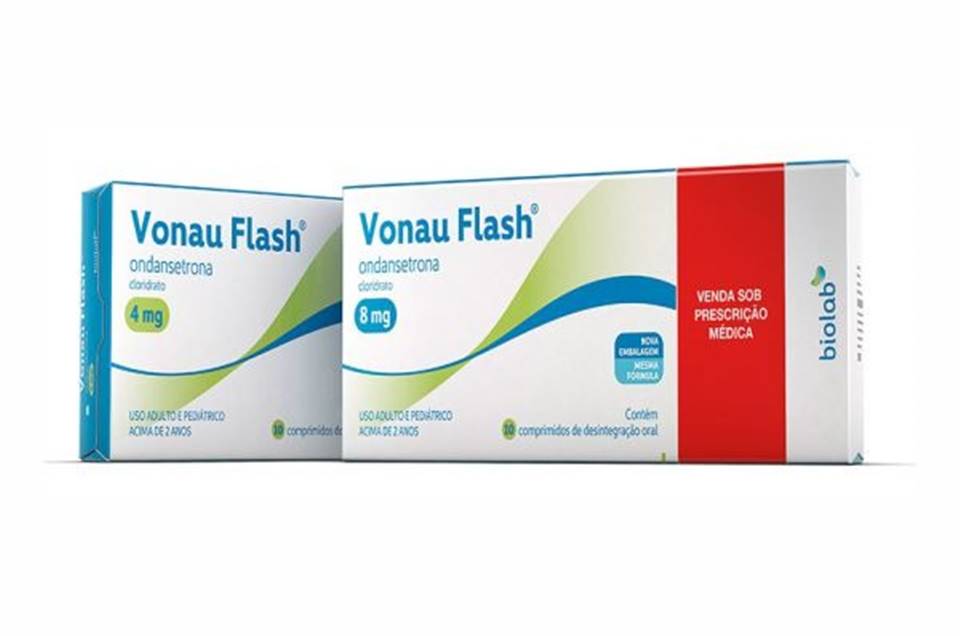
Alerta da Anvisa: medicamento causa malformação orofacial no primeiro trimestre de gravidez
| viewsA Gerência de Farmacovigilância da Agência Nacional de Vigilância Sanitária (Anvisa) determina medidas sanitárias para as empresas que comercializam medicamentos com o princípio ativo ondansetrona, em virtude do risco de ocorrência de malformações congênitas com o uso desse princípio ativo.
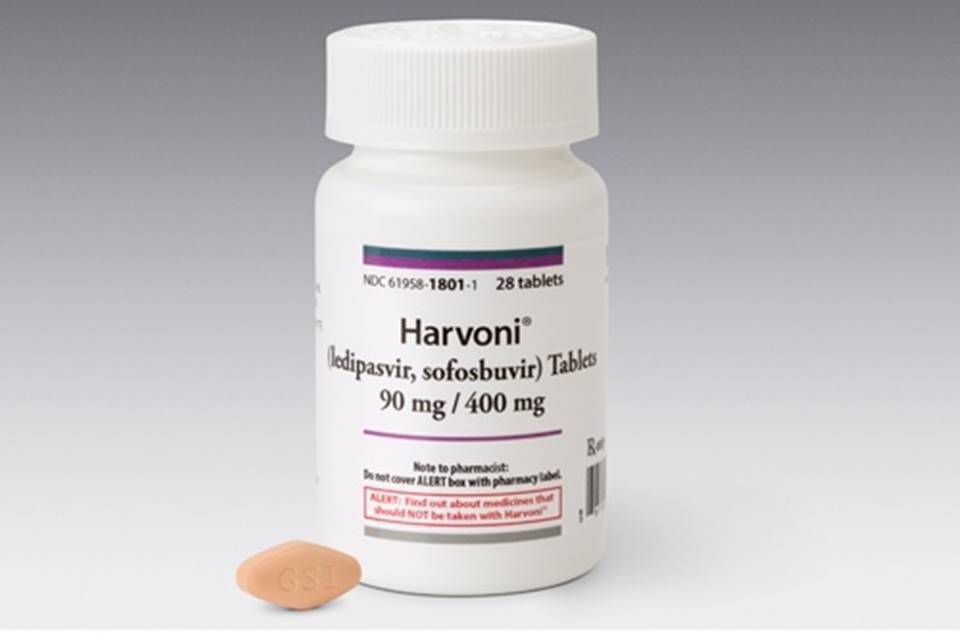
Alerta de falsificação de medicamento para hepatite C
| viewsA Anvisa alerta profissionais de saúde e pacientes para que fiquem atentos à circulação de uma versão falsificada do medicamento Harvoni, da empresa Gilead Sciences Farmacêutica do Brasil Ltda., indicado para o tratamento da hepatite C crônica (HCC), genótipo 1, em adultos e crianças acima de 12 anos.
Alerta: Anvisa abre consulta pública sobre medicamentos e insumos farmacêuticos
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) abriu a consulta pública 805/20 para o envio de comentários e sugestões pertinentes à Certificação de Boas Práticas de Distribuição e Armazenagem (CBPDA), documento que atesta as boas condições de empresas armazenadoras, distribuidoras e importadoras de medicamentos, produtos para a saúde e insumos farmacêuticos.
Alerta: Anvisa adverte para erros de medicação em produtos rotulados em outro idioma
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) emitiu alerta aos profissionais de saúde para o risco aumentado de erros de medicação relacionados aos produtos importados que possuem embalagens e bula em outro idioma. Medida emergencial na pandemia permitiu distribuição de medicamentos nessas condições.
Alerta: Anvisa anuncia substituição do Bulário Eletrônico
| viewsEm comunicado oficial, a Agência Nacional de Vigilância Sanitária (Anvisa), destacou que sua atual ferramenta de pesquisa de bulas de medicamentos, o Bulário Eletrônico, será substituída até o final de setembro de 2020. Segundo o órgão sanitário, a medida visa promover melhorias no sistema e fornecer um serviço melhor.
Alerta: Anvisa cancela registro de apresentações do Estomazil
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) determinou o cancelamento de registro de apresentações do Estomazil, fabricado pela Cosmed Indústria de Cosméticos e Medicamentos (do grupo Hypera), a pedido da empresa. Ainda segundo a companhia, essas unidades não estavam mais sendo comercializadas pela indústria. A medida foi publicada por meio da Resolução (RE) 2.391, de 9 de julho de 2020.
Alerta: Anvisa cancela registro de medicamentos de 5 Indústrias Farmacêuticas
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) cancelou o registro de algumas apresentações de seis medicamentos, que pertencem a cinco indústrias farmacêuticas renomadas. Entre as substâncias estão: o Fosfato de Clindamicina e o Nitrato de Miconazol (ambos da Prati-Donaduzzi); o Novocilin (do Aché Laboratórios); o Nortrigin (da Cipla Brasil Importadora e Distribuidora de Medicamentos); a Losartana Potássica (da Pharlab Indústria Farmacêutica) e o Dormium (da União Química).
Alerta: Anvisa cancela registro de quatro medicamentos
| viewsA Diretoria Geral de Medicamentos e Produtos Biológicos da Agência Nacional de Vigilância Sanitária (Anvisa) anunciou nesta segunda-feira (27/4) o cancelamento do registro sanitário de medicamentos, produtos biológicos e insumos farmacêuticos ou de apresentações, por meio da Resolução (RE) 1.240/20.
Alerta: Anvisa cancela registros de 52 apresentações de medicamentos
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) determinou o cancelamento de registro de 52 apresentações de medicamentos, de quatro indústrias farmacêuticas diferentes. Entre as substâncias estão: carbonato de cálcio + colecalciferol e Osteoduo (da Althaia); Valtrian HCT (da Sanofi); Derms (da União Química); algestona acetofenida + enantato de estradiol, Menoprin, enantato de noretisterona + valerato de estradiol e Pyverm (todos quatro da Mabra). As informações foram publicadas por meio da RE 2.147/20 e da RE 2.149/20, ambas de 25 de junho de 2020, no Diário Oficial da União (D.O.U.).
Alerta: Anvisa cancela registros de lotes de 4 medicamentos
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) determinou o cancelamento de apresentações (lotes) de quatro medicamentos que pertencem cada um deles a indústrias farmacêuticas diferentes. Entre as substâncias estão: a cefalotina sódica, da empresa Antibióticos do Brasil; o Mononine (fator IX de coagulação), da CSL Behring; Trulicity (dulaglutida), da Eli Lilly; e cetoconazol, do laboratório Globo. As informações foram divulgadas por meio da RE 1.857, de 5 de junho de 2020, no Diário Oficial da União (D.O.U.).
ALERTA: Anvisa cancela registros de medicamentos da Germed e da Medquímica
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) cancelou o registro de apresentações de alguns medicamentos de indústrias farmacêuticas renomadas, entre as substâncias estão: o Cloridrato de Pioglitazona e o Cloridrato de Duloxetina, ambos da Germed; e o Tioconazol + Tinidazol, da Medquímica Indústria. As informações foram publicadas por meio da RE 1.137, em 16 de abril de 2020, no Diário Oficial da União (D.O.U.).
Alerta: Anvisa cancela registros dos medicamentos Resfedryl, Tilonax e Eprex
| viewsA Agência Nacional de Vigilância Sanitária (Anvisa) cancelou o registro de alguns medicamentos de indústrias farmacêuticas renomadas, entre os fármacos estão: o Tilonax, da Cifarma Científica; o Eprex, da Janssen; o Resfedryl, da Pharmascience Indústria Farmacêutica; e o fitoterápico Espinheira Santa, da Orient Mix. Além disso, houve cancelamentos também referentes aos produtos: Vaxigrip, Avaxim, Medvitd3, vacina poliomielite 1, 2 e 3 (inativada), Tetraxim, vacina contra raiva (inativada) e Euvax B, todos da Sanofi. As informações foram publicadas por meio da RE 1.048, de 9 de abril, no Diário Oficial da União (D.O.U.).