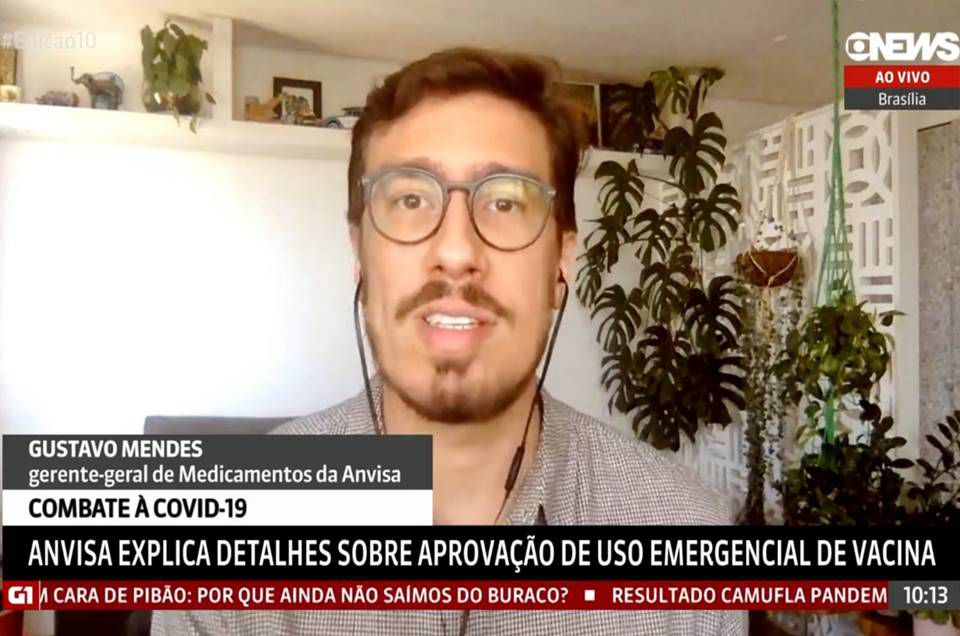
A Agência Nacional de Vigilância Sanitária (Anvisa) pode autorizar o uso emergencial e temporário de vacinas contra o novo coronavírus (Covid-19) no Brasil. Como o assunto tem gerado muitas dúvidas, o farmacêutico e professor do ICTQ - Instituto de Pesquisa e Pós-Graduação para o Mercado Farmacêutico, Gustavo Mendes, (foto), que também é gerente-técnico na Anvisa, esclareceu algumas questões sobre o tema durante entrevista à Globo News, que aconteceu hoje (03/12).
Durante a transmissão, Mendes explicou quem poderá receber o imunizante, caso o uso emergencial seja autorizado pela Agência reguladora: “A ideia é autorizar o uso emergencial para populações específicas, então, a empresa [que deseja conseguir o aval] terá que detalhar que [o pedido] de autorização para o uso do imunizante, caso decida seguir por essa via, será para populações, como, por exemplo, idosos ou profissionais de saúde”, afirmou.
Ele continua: “Para isso, a empresa terá que adotar uma série de medidas e assumir alguns compromissos, como monitorar eventos adversos ou reações que possam ocorrer com o uso da vacina. Então, a ideia é a gente [Anvisa] identificar pontos críticos para essa autorização de uso emergencial, para que possamos garantir que o acesso seja mais rápido para esse grupo”.
Mendes ainda ressaltou que a autorização de uso emergencial é destinada para as vacinas que já estão com estudos em andamento em território nacional. “Atualmente, são quatro que foram aprovadas [as análises] no momento, a gente [a Anvisa] já possui uma série de dados para que possamos otimizar essa decisão de uso emergencial”, revelou.
Receba nossas notícias por e-mail: Cadastre aqui seu endereço eletrônico para receber nossas matérias diariamente
O farmacêutico ainda destacou que não houve, por hora, um limite de tempo determinado para que os laboratórios farmacêuticos peçam a autorização para liberação do uso emergencial dos seus respectivos imunizantes.
“Nós [Anvisa] não nos comprometemos com tempo relacionado a esse pedido, mas a questão é a seguinte: essas vacinas continuam em estudo e essas análises precisam continuar, esse é um compromisso que a empresa tem que adotar, a gente vai autorizar o uso emergencial, caso as empresas solicitem, e os estudos seguirão até que as empresas completem os dados necessários do registro definitivo para imunização em massa”, enfatizou ele.
Segundo Mendes, na avaliação de uso emergencial será analisado se o benefício compensa o risco: "Se isso estiver muito claro, vamos conseguir proceder com esse tipo de autorização", ponderou.
Autorização x registro
Ao ser questionado sobre a possibilidade de as companhias farmacêuticas optarem por não solicitar o uso emergencial, em caso da escolha pelo pedido de registro definitivo, como é o caso do Instituto Butantan, que, segundo a Globo News, deseja solicitar a aprovação final da CoronaVac, Mendes explicou que isso é possível.
“Essa será uma decisão da empresa, pois, a autorização de uso emergencial é uma prerrogativa, uma possibilidade que já estava prevista. Nós [Anvisa] apenas colocamos quais são os requisitos mínimos para esse tipo de autorização, mas não é uma obrigação, a empresa pode verificar que, de repente, já tem condições de cumprir com o que é exigido para o registro. A diferença é que, para uso emergencial, nós focamos apenas em populações específicas e em pontos críticos, já para o registro é necessária uma série de informações e dados robustos, para que possamos autorizar o uso em massa”, explica.
O farmacêutico completa: "Na minha perspectiva, eu vejo que a autorização de uso emergencial tem um tempo de decisão mais rápido, justamente porque focamos em pontos específicos. Já para o registro, pela nossa Resolução atual, temos um prazo de 60 dias para se manifestar", afirmou o farmacêutico, explicando que já houve inovações nesse sentido, como a implementação do procedimento de submissão contínua, que permite que as empresas enviem as informações à medida em que elas são geradas.
"O Instituto Butantan já enviou informações por meio desse procedimento, aliás, todas as empresas [que estão desenvolvendo vacinas] já enviaram informações por esse procedimento, acreditamos que quanto mais a gente conseguir avaliar os dados por esse procedimento, de submissão contínua, mais rápida será nossa decisão para o registro final. Então, esses 60 dias podem ser reduzidos, dependendo da porcentagem de dados que a gente consiga avaliar pelo procedimento de submissão contínua", afirmou ele.
Farmacêuticos na decisão
O professor do ICTQ explicou que há farmacêuticos na Anvisa envolvidos na decisão de autorização da liberação da vacina contra Covid-19 no Brasil. “Nós somos especialistas em regulação e vigilância sanitária, nós temos formações multidisciplinares. No grupo específico que está trabalhando com vacinas há uma equipe de vinte profissionais, entre farmacêuticos, médicos, biomédicos, estatísticos, todos com no mínimo dez anos de experiência na avaliação de medicamentos, vacinas e dados de pesquisas clínicas, pois, quando falamos em avaliação, o nosso trabalho é confrontar os dados”, ressalta.
Ele complementa: “Verificamos aquelas alegações que a empresa está apresentando, como, por exemplo, 90% de eficácia, segurança alta com poucos eventos adversos. Nosso trabalho é confrontar isso por meio da avaliação dos dados brutos, que são os dados que são gerados durante as pesquisas clínicas. A nossa expertise é justamente essa, nós temos experiência em datar esses dados, recalculá-los e realizar uma avaliação isenta. Essa experiência que nós temos é fruto de um trabalho de convergência regulatória, que significa um trabalho em conjunto que a Anvisa realiza com outras Agências reguladoras [de outros países]”.
Mendes finaliza: “Sabemos que é uma decisão muito importante e crítica, neste momento, por isso estamos comprometidos com o rigor técnico e com toda nossa experiência para tomar a decisão correta”, encerrou o farmacêutico.
Assista ao vídeo do farmacêutico durante a transmissão da Globo News:
Participe também: Grupos de WhatsApp e Telegram para receber notícias farmacêuticas diariamente.
Obrigado por apoiar o jornalismo profissional
A missão da Agência de notícias do ICTQ é levar informação confiável e relevante para ajudar os leitores a compreender melhor o universo farmacêutico. O leitor tem acesso ilimitado às reportagens, artigos, fotos, vídeos e áudios publicados e produzidos, de forma independente, pela redação da Instituição. Sua reprodução é permitida, desde que citada a fonte. O ICTQ é o principal responsável pela especialização farmacêutica no Brasil. Muito obrigado por escolher a Instituição para se informar.