É indiscutível que a Validação de Métodos Analíticos é um requisito exigido às indústrias farmacêuticas pelas agências reguladoras. De acordo como professor do ICTQ - Instituto de Pesquisa e Pós-Graduação para o Mercado Farmacêutico, dr. Pedro Canuto Vieira da Costa, o FDA define que a validação é “O estabelecimento de evidência documental que demonstra com alta confiabilidade que um processo específico vai constantemente produzir um produto com as especificações pré-determinadas e atributos de qualidade”.
As boas práticas de fabricação de medicamentos (RDC 17/10 – Anvisa) definem a validação de forma semelhante ao conceituá-la como um “Ato documentado que ateste que qualquer procedimento, processo, equipamento, material, atividade ou sistema realmente e consistentemente leva aos resultados esperados”.
“Aplicando estas definições aos Métodos Analíticos, ou seja, aos testes de controle de qualidade, presumimos que devem haver evidências documentais suficientes que demonstrem a confiabilidade dos resultados obtidos”, cometa ele. O ato de validar os métodos analíticos não deve ser entendido apenas como um requisito legal (vide art. 25 da RDC 17/17), mas como uma prática cultural que previne falhas, agrega valor ao produto e estabelece as melhores formas de conduzir as análises, tudo isso visando a segurança dos pacientes.
O marco legal concernente à validação de métodos analíticos teve início em 2002, com a publicação da RE 475, sendo que o ato normativo mais recente foi publicado em 2017, conforme tabela abaixo:

Trazendo o assunto para o foco da discussão, na validação de métodos analíticos microbiológicos torna-se necessário destacar os seguintes parágrafos extraídos destas normativas:
 “Verifica-se nestes parágrafos que há um racional específico para métodos analíticos que possuem um aspecto biológico envolvido. Se traçarmos um paralelo entre métodos físico-químicos e biológicos, encontraremos diferenças significativas quanto ao nível de controle dos parâmetros envolvidos na análise”, afirma o professor.
“Verifica-se nestes parágrafos que há um racional específico para métodos analíticos que possuem um aspecto biológico envolvido. Se traçarmos um paralelo entre métodos físico-químicos e biológicos, encontraremos diferenças significativas quanto ao nível de controle dos parâmetros envolvidos na análise”, afirma o professor.
Uma reação química obedecerá estritamente os fundamentos da natureza e dependerão de fatores como reagentes, equipamentos e vidrarias. Se estes parâmetros forem bem conhecidos e pré-determinados, cria-se um cenário muito favorável para obtenção de resultados analíticos consistentes. Porém, um método biológico pode envolver parâmetros como atividade enzimática e crescimento microbiano, ou seja, são fatores ligados à própria complexidade dos seres vivos.
Certamente não é tarefa simples “engarrafar e rotular” um microrganismo ou substância biológica, pelo menos quando fazemos a comparação como substâncias químicas. Basta perceber que o grau de variabilidade das substâncias biológicas padronizadas costuma ser muito maior do que nas químicas.
Portanto, ao lidar com Validação de Métodos Analíticos Microbiológicos deve-se estar cientes de que diversos serão os desafios, e estes estão basicamente ligados ao lidar com o fator vida sob uma necessidade de torna-lo o mais exato possível. “Cabe a nós realizar a validação dos métodos microbiológicos na extensão em que for possível, prezando pela justificativa técnica da abordagem escolhida”, defende Costa.
Estrutura Documental
Os documentos de validação de métodos analíticos se assemelham àqueles necessários para os diversos tipos de validação, como de processo, limpeza, transporte e sistemas computadorizados. Pode-se traçar o seguinte diagrama:
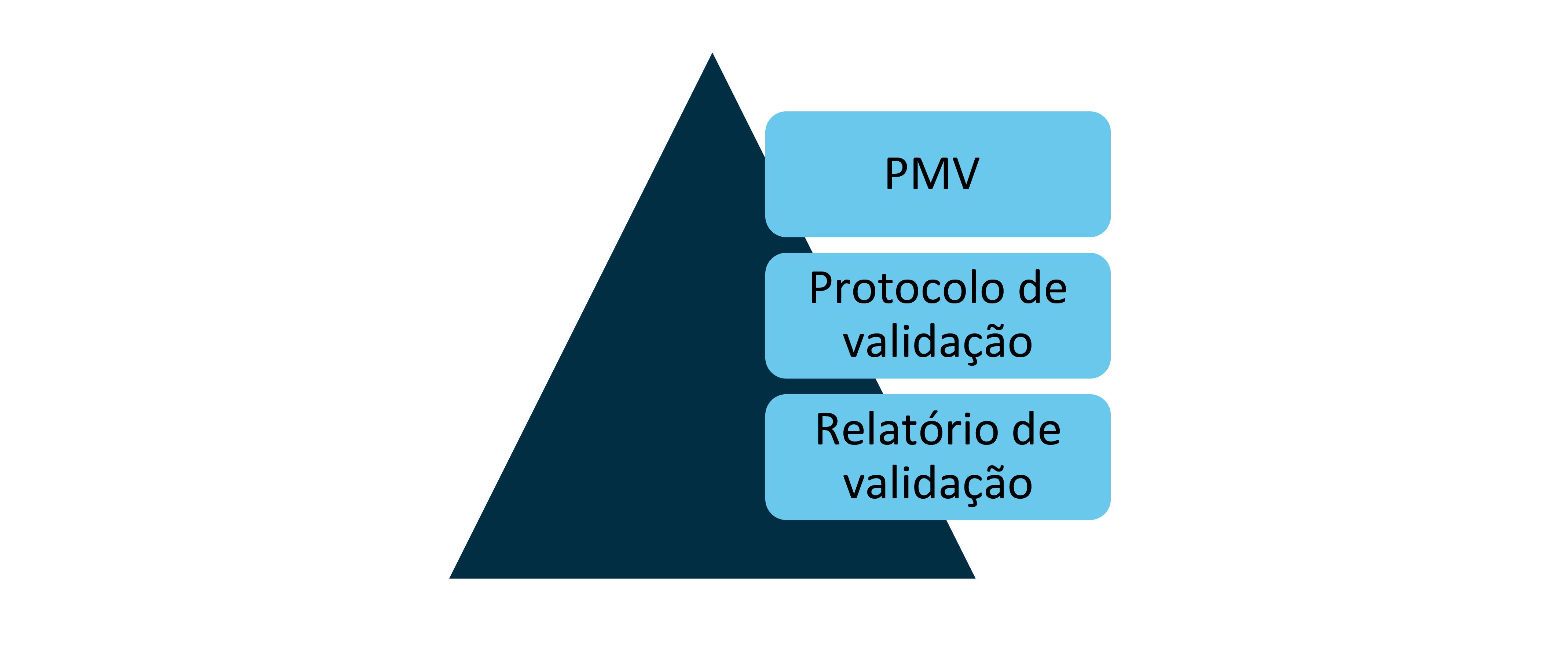
O PMV, plano mestre de validação, tem como objetivo estabelecer o Planejamento de todas as atividades de validação, elencando os objetivos, procedimentos, prazos e responsabilidades definidos. Alguns tópicos que pode conter são:
- Política de validação;
- Estrutura organizacional das atividades de validação;
- Sumário (situação atual e programação);
- Modelos de documentos ou referência a eles;
- Planejamento e cronograma;
- Controle de mudanças;
- Referências a outros documentos existentes.
O protocolo de validação tem por objetivo determinar o procedimento que será seguido no decorrer da validação e registrar as justificativas técnicas que embasaram esta escolha, tais como referências compendiais, guias internacionais, melhores práticas de mercado ou decisões tomadas por meio de análise de risco.
Portanto, o Protocolo de Validação é um documento com cunho técnico-operacional, focado exatamente no método analítico a ser validado. Pode-se considerar que esse documento é o precursor do Procedimento Operacional Padrão que será gerado a partir da validação. O protocolo pode conter as seguintes informações:
- Objetivo;
- Responsabilidades e autoridades;
- Plano de validação;
- Aplicação;
- Embasamento técnico;
- Requerimentos;
- Materiais;
- Procedimento;
- Resultados esperados;
- Critérios de revalidação;
- Relatório de validação;
- Histórico.
Segundo Costa, o relatório de validação compilará o resultado dos testes que foram realizados, sinalizando desvios que porventura ocorreram no processo e o fechamento dos mesmos. O principal tópico que deve ser claramente visível no documento é a conclusão da validação, ou seja, se o método analítico foi ou não validado. Não é incomum que o relatório seja iniciado com essa informação, o que facilita a rápida visualização em casos de auto inspeções ou de auditorias de vigilância sanitária. Segue uma relação dos pontos usualmente contidos no relatório:
- Mesmo conteúdo do protocolo;
- Resumo dos resultados;
- Parâmetros analíticos detalhados;
- Desvios ocorridos;
- Participantes;
- Considerações;
- Conclusão;
- Histórico.
“Vale ressaltar que a estrutura documental de validação faz parte do sistema de qualidade estabelecido na empresa. Os nomes, modelos e formatos de documentos poderão variar de uma para outra”, destaca o porfessor. Habitualmente as empresas adotam um Plano Mestre de Validação específico para tratar dos Métodos Analíticos, e este documento tem uma periodicidade anual. Isso possibilita que no tópico de Planejamento e cronograma, seja apresentado um balanço das atividades de validação de métodos do ano anterior e as atividades programadas para o ano corrente. Isso torna bastante visual a identificação dos métodos validados anteriormente e os que serão validados no ano corrente.
Parâmetros de validação de métodos analíticos microbiológicos
É evidente que a regulamentação atual de validação de métodos analíticos é focada em físico-química, se eximindo de fazer norteamentos claros para métodos microbiológicos. Nesse sentido, a informação mais relevante que pode ser extraída da RDC 166/2017, que é a regulamentação vigente no tocante a estes métodos, é a seguinte:

Sendo assim, a adaptação do contexto físico-químico adotado na RDC 166/17 para o contexto microbiológico é uma conduta permitida. Seguindo esta perspectiva, podemos traçar o seguinte paralelo de definições de parâmetros de validação:
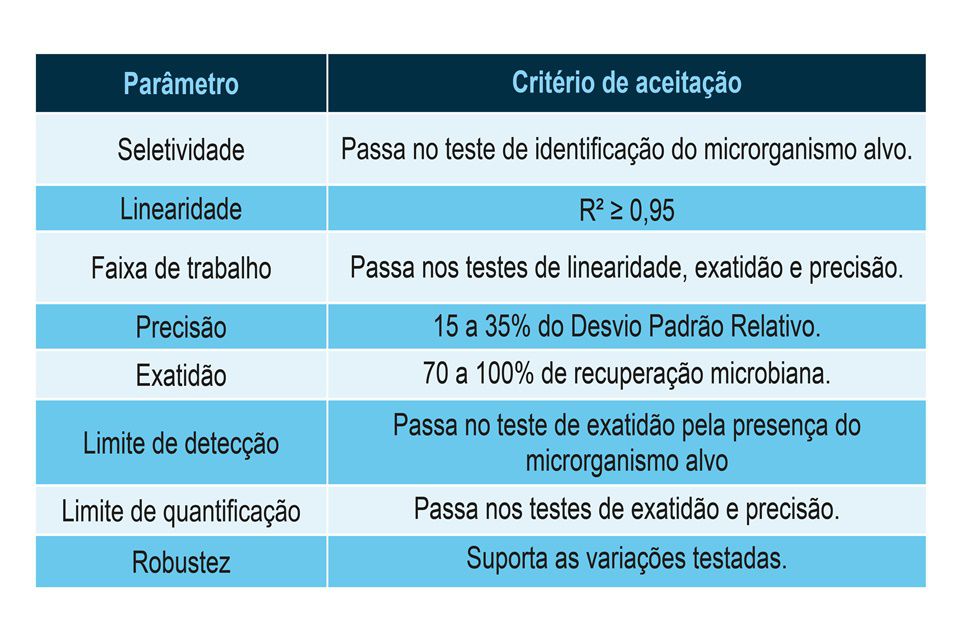
Feito isto, pode-se então estabelecer critérios de aceitação para cada um destes parâmetros. É necessário considerar a variabilidade natural dos testes microbiológicos que, como explicado anteriormente, está relacionada ao fator vida. Em geral, podem ser aplicados os seguintes critérios:
Para completar o racional, devemos saber os parâmetros que serão estudados em cada validação de método analítico microbiológico. “De forma geral, podemos dividir os métodos em dois grupos: qualitativos e quantitativos. Exemplificando: testes de esterilidade e de pesquisa de patógenos pertencem ao grupo dos testes qualitativos, enquanto que determinação de biocarga pertence ao grupo de testes quantitativos”, menciona Costa.
Assim, pode-se fazer a seguinte correlação da aplicabilidade dos parâmetros de validação aos diferentes grupos:
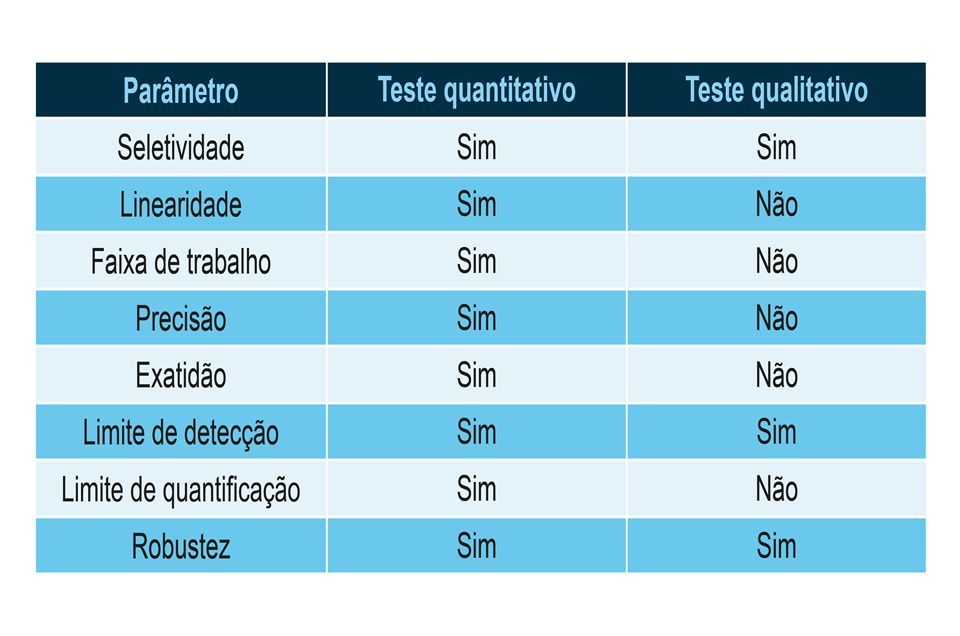
Cabe ressaltar que cada método microbiológico deve ser estudado na sua individualidade quando da elaboração do Protocolo de Validação. É recomendável que este documento respalde a estratégia de validação adotada apresentando as justificativas técnicas e a análise de risco que embasaram as decisões estratégicas de validação.
Métodos microbiológicos compendiais
Considerando que a Farmacopeia Brasileira tem suas limitações em relação a revisões periódicas, o que a torna desatualizada, é comum adotar as Farmacopeia Americana (USP) e a Farmacopeia Europeia (EP) no contexto dos métodos microbiológicos, de acordo com o professor.
Os métodos compendiais mais comumente utilizados em laboratórios de microbiologia são os seguintes:
- USP <61> Microbiological Examination Of Nonsterile Products: Microbial Enumeration Tests
- USP <62> Microbiological Examination Of Nonsterile Products: Tests For Specified Microorganisms
- USP <71> Sterility Tests
- USP <85> Bacterial Endotoxin Tests
- USP <1033> Biological Assay Validation
- USP <1208> Sterility Testing
- USP <1223> Validation Of Alternative Microbiological
- EP 2.06.01 Sterility
- EP 2.06.12 Microbiological Examination Of Non-sterile Products: Microbial Enumeration Tests
- EP 2.06.14 Bacterial Endotoxins
Para esses métodos, a RDC 166/17 estabelece o seguinte:

Nesse sentido, ao conduzir a validação de um método compendial, é permitido reduzir os parâmetros a serem avaliados, desde que sejam apresentadas tanto a análise de risco como as justificativas técnicas para tal, preferencialmente em protocolo de validação.
Cabe destacar que as monografias referentes à dosagem de endotoxinas possuem um racional próprio para validação destes testes, devido a sua enorme particularidade.
Outros aspectos importantes de validação de métodos analíticos microbiológicos
“Para garantir a consistência dos métodos analíticos a serem validados, é imprescindível uma preparação prévia do laboratório, que perpassa infraestrutura, pessoas, equipamentos e insumos, além da documentação de validação, que já foi discutida previamente. Podemos englobar estes aspectos nas chamadas Boas Práticas de Laboratório Microbiológico, e é recomendável que estejam escritas em um documento da qualidade”, comenta Costa.
O laboratório de microbiologia deve ser segregado dos demais. Seu ambiente deve ser limpo e organizado, dispondo de uma infraestrutura de bancadas, armários, piso, utilidades e ar-condicionado adequados às atividades nele desempenhadas. Obedecendo aos conceitos mais modernos de Quality by Design e Lean Six Sigma, idealmente a arquitetura e a disposição dos equipamentos no laboratório deve favorecer o fluxo do processo (semeadura, isolamento, identificação, desinfecção, esterilização, lavagem etc.).
As pessoas que trabalharão no laboratório de microbiologia devem passar por rigoroso treinamento de higiene e técnicas assépticas, de modo a evitar o aparecimento de resultados falsos positivos e que gerarão um enorme trabalho de investigação de resultados fora de especificação. “Evidentemente, todos os analistas deverão ser treinados nos requisitos gerais do sistema da qualidade e nos procedimentos que executam no laboratório. Ainda, o perfil desejado para estes profissionais deve ser exaustivamente detalhado de forma a assegurar bons microbiologistas na área”, fala o professor.
Os equipamentos do laboratório de microbiologia devem integrar o inventário farmacêutico da fábrica, assegurando que passem por calibrações, verificações, manutenções e qualificações periódicas. Devem ter Procedimentos Operacionais Padrão escritos e de fácil consulta para garantir a correta utilização dos mesmos.
Da mesma maneira, os logbooks devem estar próximos para facilitar o registro de ocorrências (uso, verificação, manutenção, limpeza etc.). Nesse aspecto, deve ser dada especial atenção às incubadoras, cabines de segurança biológica e equipamentos de filtração em membrana, considerados equipamentos-chave no laboratório.
Os insumos críticos do laboratório devem estar listados em documento da qualidade, indicando quais os fornecedores qualificados para cada um. Esta indicação deve considerar os insumos testados na avaliação do parâmetro de robustez.
É comum que a lista de insumos críticos inclua os meios de cultura, cepas padrão e materiais estéreis. Vale lembrar que os insumos críticos devem ser recebidos com os respectivos certificados de análise e que devem ser testados lote a lote e a cada recebimento antes de serem liberados para uso, conforme o caso.
Os meios de cultura, sejam adquiridos ou preparados no laboratório, devem ser amostrados e submetidos aos testes de esterilidade e de promoção de crescimento antes da disponibilização para uso, conforme determinado nos compêndios oficiais. Os meios mais comumente utilizados são TSA, Tioglicolato, Sabouraud e R2A, além de alguns meios seletivos para patógenos, como cetrimida, McConkey e XLD.
As cepas padrão devem ser adquiridas de fornecedores qualificados e acompanhadas de certificados de autenticidade. É imprescindível que o fornecedor informe aos clientes o número de passagem das cepas, já que não é recomendável utilizá-las após a quinta geração.
Por isso, é necessário que elas sejam cuidadosamente mantidas no laboratório, contando, se possível, com um analista especialmente designado para realizar os repiques e manutenção. As CEPAS mais comumente mantidas no laboratório, e que atendem as necessidades mais usuais dos testes de promoção de crescimento, são as seguintes:
- ATCC 6538 Staphylococcus aureus;
- ATCC 8739 Escherichia coli;
- ATCC 9027 Pseudomonas aeruginosa;
- ATCC 6633 Bacillus subtilis;
- ATCC 14028 Salmonella typhimurium;
- ATCC 10231 Candida albicans;
- ATCC 16404 Aspergillus brasiliensis.
Segundo Costa, outro fator de suma importância é o conhecimento das capacidades antimicrobianas dos diferentes analitos. Estas devem ser neutralizadas antes da execução dos testes, para que o crescimento microbiano não sofra interferências. Isso é especialmente importante caso o laboratório de microbiologia seja responsável por realizar o monitoramento ambiental das salas classificadas da fábrica, onde há constante uso de agentes bactericidas e bacteriostáticos. Certos meios de cultura já contam com neutralizantes inseridos na sua formulação, mas, ainda assim, a Farmacopeia Brasileira lista os seguintes agentes neutralizantes.
Exemplo de validação de método analítico microbiológico: determinação da biocarga
Consolidando todas as informações acima apresentadas, podemos, para efeito didático, fazer um resumo simplificado de como se daria a validação do método analítico de determinação de biocarga em água purificada. É preciso dividir a validação do método analítico em três fases: fase de pré-teste, fase de teste e fase de pós-teste.
Primeiramente, deve-se contextualizar o cenário, respondendo a algumas perguntas, que auxiliarão na condução do processo:
- Qual o analito? Água purificada.
- Qual a biocarga esperada? < 100 UFC/mL, segundo a Farmacopeia Brasileira.
- Qual o potencial bactericida do analito? Nenhum.
- Qual o meio de cultura mais adequado ao teste? Ágar R2A.
- Qual o método a ser utilizado? Filtração em membrana.
- O método é compendial? Sim (USP <61> ou EP 2.06.12)
- O método é qualitativo ou quantitativo? Quantitativo.
- Quais equipamentos serão utilizados? Aparelho de filtração em membrana e incubadoras.
Com isso em vista, prossegue-se para:
- Fase de pré-teste.
Aqui é preciso realizar a análise de risco para verificar a criticidade do método e também os fatores que potencialmente poderão causar sua variabilidade. Assim, fica definido que as seguintes condições precisam estar cumpridas para poder realizar a validação: há um sistema da qualidade robusto, bons analistas trabalhando no laboratório, equipamentos previamente qualificados, infraestrutura adequada e meios de cultura liberados para uso dos testes de promoção de crescimento e de esterilidade.
A análise crítica define ainda os parâmetros de validação a serem estudados. Apesar das definições da RDC 166/17, que permitiria fazer um estudo simplificado, é fundamental explorar todos os parâmetros de validação para efeito didático.
“Além disso, é necessário que tenhamos um PMV respaldando a atividade de validação que executaremos além de um protocolo de validação do método, que deve conter todas as informações que estão sendo aqui exemplificadas”, explica Costa.
- Fase de teste
É a validação em si. Para isso, pode-se preparar um grupo teste (amostra), um grupo controle (WFI contaminada com uma quantidade conhecida de microrganismos, que foi preparada com CEPA padronizada) e um grupo Branco (WFI).
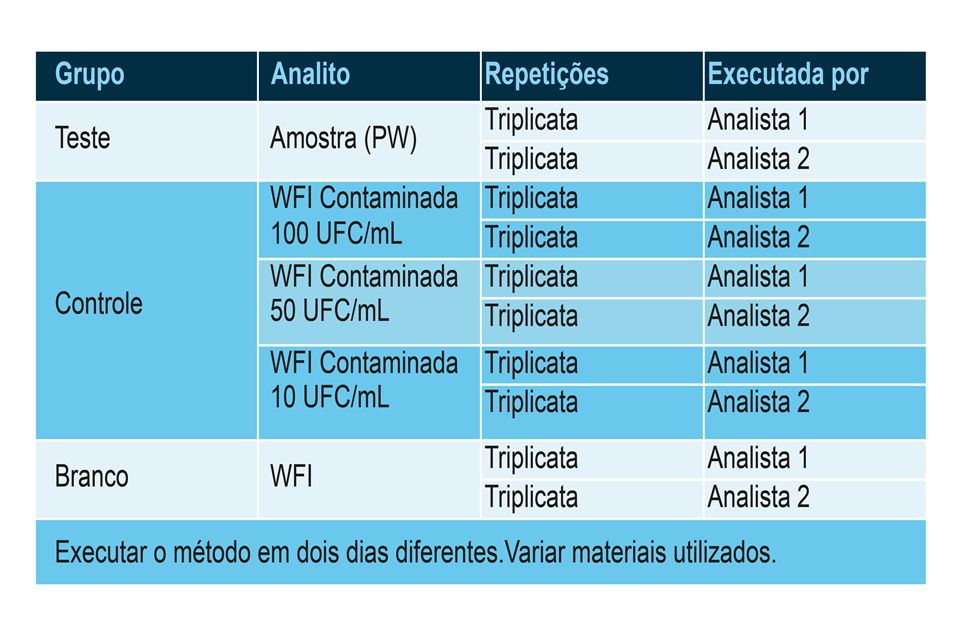
É interessante ter um rascunho do procedimento operacional padrão do método analítico para nortear o passo a passo dos analistas. Como o documento ainda está em fase de rascunho, é conveniente fazer as modificações necessárias para inseri-lo no sistema de qualidade da forma mais fidedigna e adequada possível.
- Pós-teste
A fase de pós-teste é realizada com incubação das placas e posterior leitura e análise estatística dos resultados.
O resultado esperado para o grupo branco, obviamente, é o de ausência de microrganismos. Caso contrário, nosso estudo estaria invalidado.
Já para o grupo controle, espera-se que as triplicatas contenham a quantidade esperada de microrganismos para a baixa, média e alta concentrações. É importante que os microrganismos do grupo controle sejam selecionados com base nos que seriam usualmente esperados nesse tipo de análise.
Para o grupo teste, percebe-se que os parâmetros de validação estão sendo avaliados da seguinte forma e que devem ter os seguintes resultados esperados:
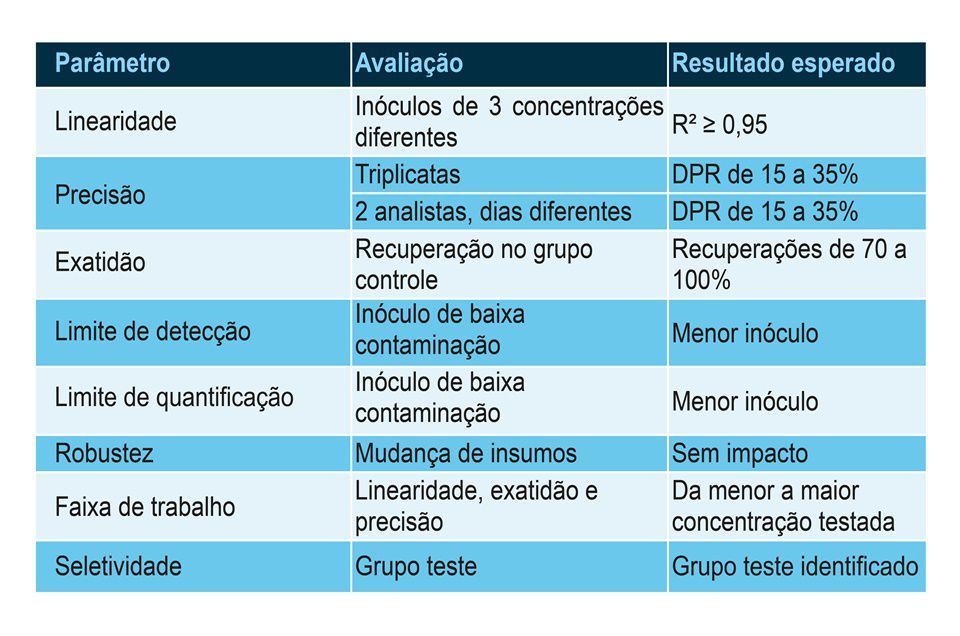
“Para a linearidade, esperamos que as três preparações de microrganismos do grupo controle (alta, média e baixa contaminações) possam ser representadas graficamente com uma curva de regressão linear com R² ≥ 0,95”, ensina Costa.
Em termos de precisão, espera-se que o Desvio Padrão Relativo entre as replicatas de um mesmo analista e entre as dos dois diferentes analistas esteja contido entre 15 e 35%.
Para a exatidão, todas as amostras do grupo controle devem ser recuperadas em 70 a 100% da sua biocarga. Vale lembrar que os inóculos para preparar o grupo controle foram obtidos de CEPAS padronizadas de UFC conhecida. É recomendável que sejam feitos inoculações diretas em duplicata das preparações para comprovar se a contaminação teórica foi realmente obtida.
Os limites de detecção e quantificação serão iguais ao inóculo de menor concentração do grupo controle. Idealmente, este valor deve ser 1 UFC/mL.
Na robustez, pode-se variar a membrana filtrante, os frascos das amostras, diferentes equipamentos de filtração. Todas essas variações não podem trazer impacto ao resultado dos testes.
A faixa de trabalho do teste será de 10 UFC/mL a 100 UFC/mL, que correspondem aos inóculos de menor e maior concentrações, respectivamente.
A seletividade será dada pelos diferentes microrganismos identificados na amostra do grupo teste. É possível, ainda, preparar grupos teste com WFI contaminada com diferentes cepas padrão para verificar se a metodologia foi capaz de selecionar esses microrganismos.
Validação é desafiadora
A validação de métodos analíticos microbiológicos é desafiadora no contexto das indústrias farmacêuticas. O foco direcionado à físico-química exige dos microbiologistas a criação de soluções embasadas em justificativas técnicas e análise de risco.
A validação pode se tornar ainda mais desafiadora a depender do espectro de atuação do laboratório de microbiologia. De acordo com o segmento da indústria, o espectro pode ser muito vasto. Para produtos estéreis, por exemplo, pode passar por testes de determinação de biocarga em matérias-primas e utilidades farmacêuticas, testes de esterilidade, monitoramento ambiental e pesquisa de endotoxinas, por exemplo.
Cada uma destas disciplinas traz consigo equipamentos diferentes, métodos diferentes e parâmetros diferentes. Cabe ao laboratório atuar junto ao setor de Garantia da Qualidade para elencar através de análise de risco quais os testes que deverão integrar a rotina de validação de métodos analíticos.
“Enquanto isso, seguimos na perspectiva de que haja uma regulação específica e direcional aos métodos analíticos microbiológicos”, conclui Costa.






