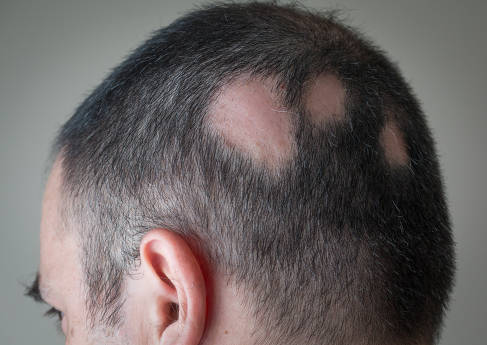
Uma formulação que combate a queda de cabelos desenvolvida a partir de ativos de um extrato biotecnológico de café mudou a vida da farmacêutica e empreendedora Jackeline Alecrim. Após dedicar quatro anos tentando desenvolver um produto antiqueda mais prático e eficaz do que os que já haviam no mercado e que também funcionasse para outras formas de alopecia, a pesquisadora conseguiu destaque nacional e internacional com sua descoberta.
Graduada em Farmácia em 2010, Jackeline ministrava aulas como professora universitária com foco em Farmacologia Clínica e Fitoativos quando percebeu que poderia empregar as competências adquiridas na área para desenvolver cosméticos grau II de alta performance. Já com o instinto mercadológico, Jackeline realizou pesquisas na internet sobre qual era o termo mais buscado no segmento de dermocosméticos. "Era queda de cabelo", lembra.
A farmacêutica observou lacunas no desenvolvimento de soluções práticas, eficazes e que aumentassem a adesão do paciente ao tratamento adjuvante da queda capilar. "Ao mesmo tempo, tinha a minha disposição uma estrutura laboratorial incrível, da universidade em que eu trabalhava, ou seja, identifiquei a possibilidade e as ferramentas que tinha naquele momento. Então, trabalhei para resolver de maneira 100% eficiente o problema de queda de cabelo", afirma.
O café, seus fitoativos e propriedades bioestimulantes, foram a inspiração para o início dos trabalhos de Jackeline, que deram origem a um xampu e um condicionador. Apesar de publicações científicas já destacarem a possível ação da cafeína isolada no tratamento da alopecia androgenética, a pesquisadora decidiu desvendar os componentes das folhas, frutos e raízes da planta.
Após toda a dedicação, Jackeline obteve ótimos resultados. Seus dermocosméticos foram submetidos ao teste de segurança e eficácia exigido pela Agência Nacional de Vigilância Sanitária (ANVISA), feitos em laboratórios credenciados, supervisionados por equipe clínica e financiados pelo desenvolvedor, de acordo com a legislação vigente. “Tive que vender um carro para pagar. Mas tivemos um resultado fantástico, de 100% de percepção de eficácia clínica antiqueda em 100% de participantes do teste, em apenas 30 dias de uso, um tempo curto, mas que era possível com o dinheiro que eu tinha. Esse foi um dos maiores diferenciais: eficácia em todos os pacientes participantes, em pouco tempo de uso, o que dá às pessoas segurança de que estão usando algo que vai fazer efeito".
Receba nossas notícias por e-mail: Cadastre aqui seu endereço eletrônico para receber nossas matérias diariamente
Segundo Jackeline, o xampu além de evitar a queda, fortalece o cabelo e aumenta o crescimento, além de ser prático, favorecer a absorção dos ativos através da ativação da microcirculação na hora da aplicação e aumentar a adesão ao tratamento. "O que existia no mercado eram tônicos, que são soluções hidro alcóolicas, que geralmente ressecam o cabelo e são chatas de aplicar. Essa nossa biotecnologia se baseia no fato de os ativos estarem num xampu aplicado pelo paciente durante o banho e continua atuando por mais 18 horas, mesmo depois do enxágue. O couro cabeludo é a nossa área externa com maior capacidade de absorção: as substâncias com tamanho e penetração adequadas já atuam diretamente no local afetado".
Mas, apesar de esse xampu dermocosmético ser revolucionário para o mercado de prevenção da calvície, não podem ser considerados uma solução definitiva, pois a alopecia androgenética é uma doença crônica que precisa de suporte por toda a vida, incluindo tratamentos adjuvantes em alguns casos.
Especialidade
A Resolução nº 406/2003 do Conselho Federal de Farmácia (CFF) regulamenta a atuação do profissional no campo da cosmetologia, que engloba a responsabilidade pelo desenvolvimento e produção de cosméticos, com ênfase naqueles que promovem alterações fisiológicas ou atuam como coadjuvantes em procedimentos de tratamento da pele, seus anexos e do couro cabeludo.
publicidade inserida(https://ictq.com.br/pos-graduacao/3567-pos-graduacao-p-d-analitico-e-controle-de-qualidade-na-industria-farmaceutica)
O segmento de indústrias cosméticas é um dos que proporcionam os melhores salários aos farmacêuticos e oferece cada vez mais vagas no mercado de trabalho. Nessas empresas, o profissional especializado em cosmetologia pode atuar nos níveis operacional, tático ou estratégico, sendo que as maiores remunerações encontram-se na atuação estratégica, ligada à gestão industrial. Na atuação magistral, existe a possibilidade de empreender e inovar. Para isso, o profissional, além do conhecimento técnico, deve buscar conhecimentos de gestão de empresas da área.
A Conselheira Federal de Farmácia por Minas Gerais, Junia Medeiros, elogia a atuação da colega farmacêutica na área da cosmetologia e parabeniza Dra Jackeline Alecrim por seu empreendedorismo. "Essa pesquisa comprova o protagonismo do farmacêutico nessa área tão importante, que está amparada por Resolução do nosso CFF e abre portas para profissionais dedicados e atentos às novas tecnologias, o que traz imensos benefícios à saúde e à estética".
Destaque internacional
Pelo seu trabalho inovador, Jackeline Alecrim foi incluída em uma lista de 30 cientistas de destaque em uma publicação internacional. A indicação foi feita por um dos maiores laboratórios farmacêuticos do mundo e incluiu o nome da mineira Jackeline Alecrim em uma obra que homenageia a trajetória feminina na ciência. O livro “A ciência com o rosto de mulher “, traduzido para o inglês e alemão retrata, em ordem alfabética, cientistas mulheres, que são apresentadas através de suas biografias e histórias de vida.
Participe também: Grupos de WhatsApp e Telegram para receber notícias