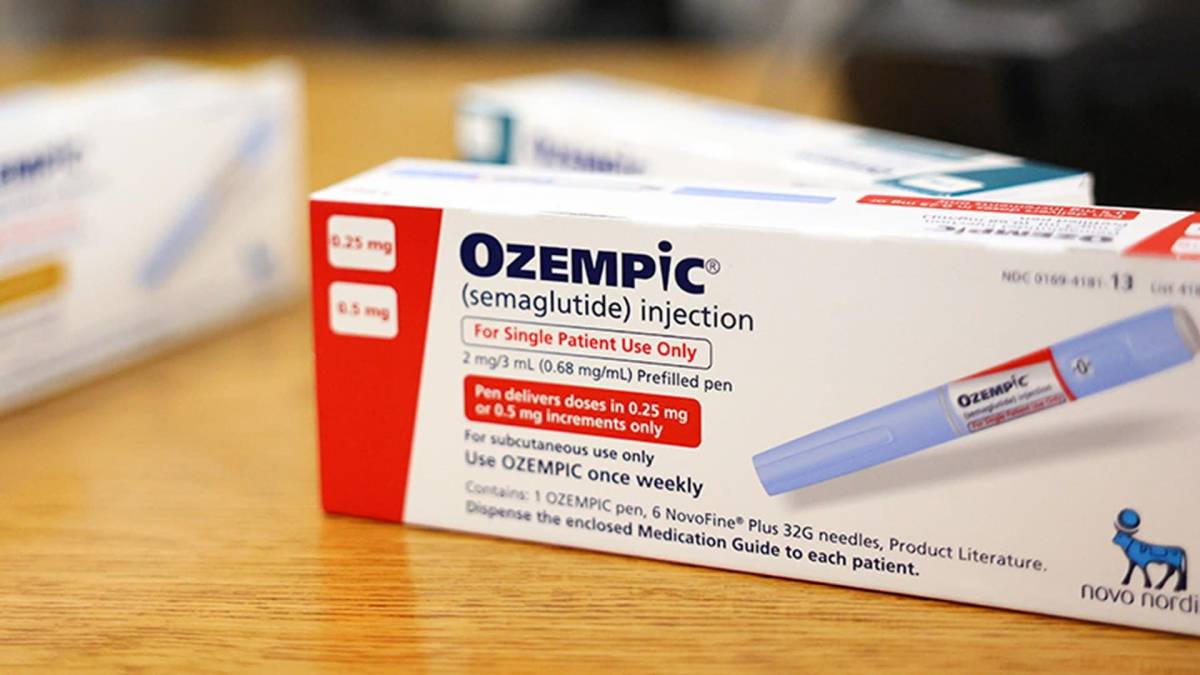
Na pandemia de Covid-19, empresas como a americana Pfizer e a britânica AstraZeneca quebraram recordes de faturamento após produzir, em tempo muito curto, vacinas que salvaram milhões de vidas. Agora, a sensação da indústria farmacêutica no mundo é a dinamarquesa Novo Nordisk. Ela tem em seu portfólio um medicamento que se enquadra à perfeição na sociedade atual por levar ao emagrecimento. Trata-se do Ozempic, remédio injetável concebido de início para o tratamento de diabetes, mas, conforme descobriu-se depois, forte aliado na luta contra a balança. Enquanto os usuários do Ozempic emagrecem, o caixa da fabricante só engorda: a farmacêutica viu seu lucro aumentar 51% em 2023. O desempenho estimulou uma alta de quase 60% das ações da companhia em um ano. Atualmente avaliada em 556 bilhões de dólares, a Novo Nordisk se tornou a companhia com maior valor de mercado da Europa e a 14ª mais valiosa do mundo. Seu impacto é visível até na economia da Dinamarca: o crescimento do PIB em 2023, de 1,8%, teria sido negativo em 0,1% sem a participação do setor farmacêutico local.